新藥專題 | 2023上半年,美國FDA批準了23款新分子實體,輝瑞、禮來…
2023-07-13 11:46
2023年,新藥上市喜訊不斷!僅上半年美國FDA已批準23款新分子實體,此外還批準了多款細胞與基因療法。
據統計,截至6月25日,2023年美國藥品審評中心(CDER)總計批準54項NDA申請和8項BLA申請,其中23款為新分子實體。
另外,美國生物制品中心(CBER)還批準了10款生物制品,包括2款基因療法、1款細胞療法、1款微生物療法和1款重組蛋白藥物。
詳細情況見下文。
23款新分子實體獲批上市
2023上半年,CDER批準23個新分子實體,包括17款化藥和6款生物藥。
化藥
表1 CDER批準的化藥新藥
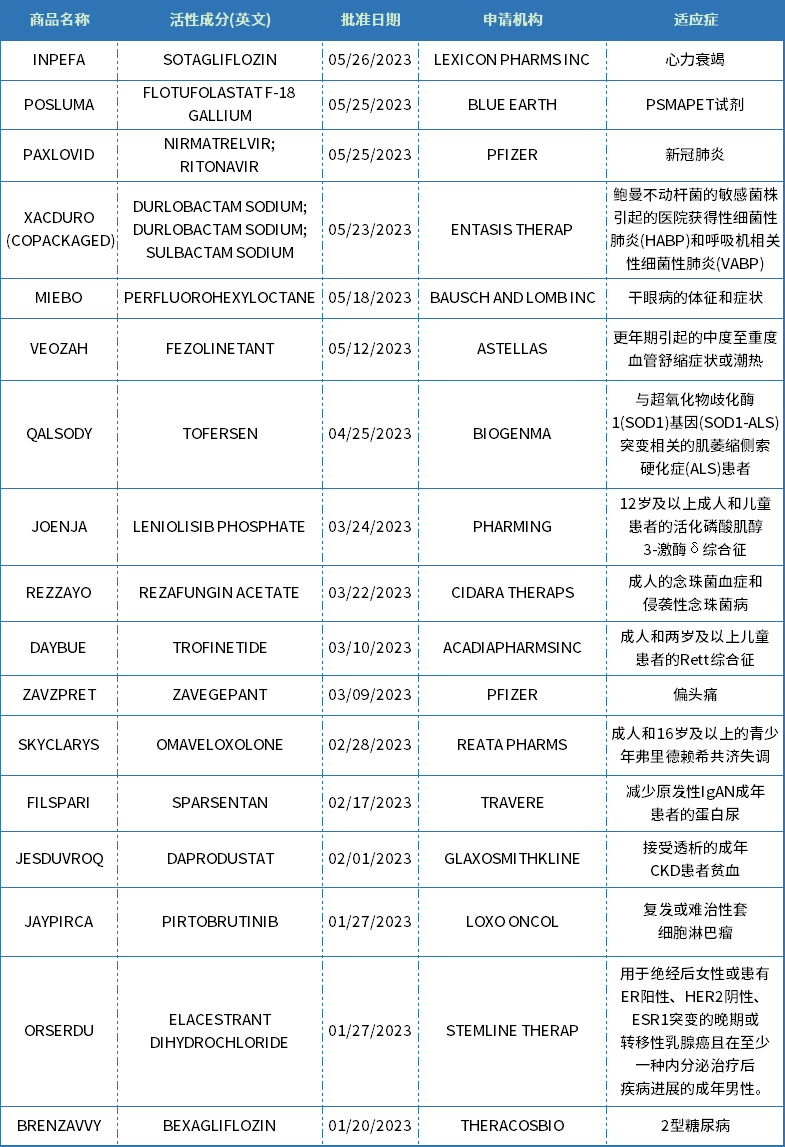
資料來源:美國FDA官網、藥智數據
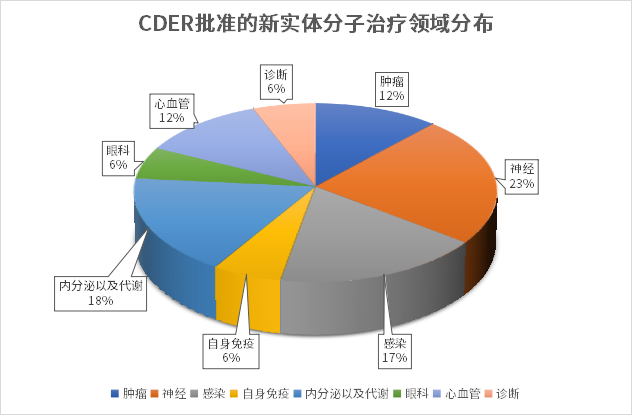
從治療領域來看,神經科學、內分泌與代謝、抗感染、腫瘤、心血管等疾病領域都有多款新藥獲批上市。2023上半年,FDA批準的小分子藥物中神經治療領域占比最多,有4款,細分來看有3款是罕見病方向。此外,內分泌與代謝領域也是今年的熱點,有BRENZAVVY、JESDUVROQ、FILSPARI三款新藥獲批。而在腫瘤領域,近些年隨著IO療法、ADC、以及CAR-T等新療法的蓬勃發展,生物藥逐漸成為腫瘤治療的主要研發方向,2023年上半年FDA批準的腫瘤治療領域小分子藥物僅有兩款,實體瘤和血液瘤各一款,而在獲批的生物藥新藥中腫瘤藥占比接近一半。
資料來源:美國FDA官網、藥智數據
從審批方式來看,11款藥物通過優先審評方式獲批上市,7款新藥曾獲得孤兒藥認證。
從申報企業來看,輝瑞成為新藥獲批的最大贏家,2023年上半年收獲2款化藥新藥,包括用于治療新冠病毒感染的PAXLOVID和偏頭痛治療藥物ZAVZPRET。此外,輝瑞的RSV疫苗ABRYSVO也在今年上半年獲得CBER批準獲上市。
生物藥
表2 CDER批準的生物藥新藥
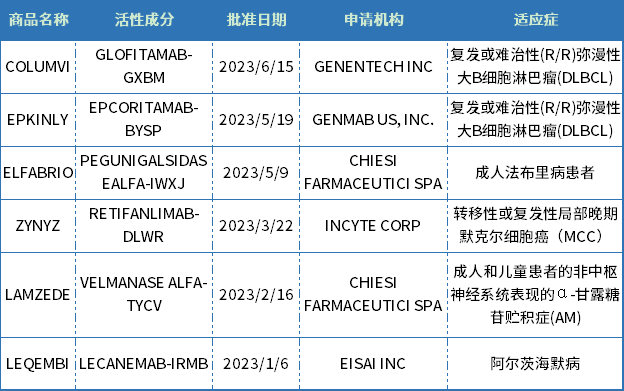
資料來源:美國FDA官網、藥智數據
截至6月25日,CDER批準了6款生物藥新藥,包括2款單克隆抗體(LEQEMBI、ZYNYZ),2款酶替代療法(LAMZEDE、ELFABRIO)、2款雙抗(COLUMVI、EPKINLY)。此外,CDER還批準了修樂美生物類似藥YUFLYMA,和Vyvgart Hytrulo皮下注射新劑型。
從治療領域來看,生物藥與化藥有所不同,主要集中在腫瘤、罕見病、自免免疫領域,其中腫瘤新藥占比近半。
從申報企業來看,CHIESI FARMACEUTICI SPA兩款罕見病新藥獲得批準,羅氏的 CD3/CD20 雙抗、衛材的AD新藥LEQEMBI獲得美國FDA加速批準上市,生物技術公司GENMAB、INCYTE也有收獲。
下面簡要介紹這幾款獲批上市的生物藥。
EPKINLY由AbbVie和Genmab共同開發的一款CD3/CD20雙抗,是FDA批準的首款用于治療成人復發或難治性彌漫性大B細胞淋巴瘤(DLBCL)患者的雙特異性抗體。
COLUMVI與EPKINLY一樣,也是一種靶向CD20和CD3的雙特異性抗體,由羅氏旗下基因泰克開發。值得一提的是,羅氏此前已有一款CD20/CD3雙抗上市產品Lunsumio,Columvi是其第二款上市的CD20/CD3雙抗。
ZYNYZ是Incyte公司開發的一款人源化抗PD-1單克隆抗體,獲批用于治療轉移性或復發局部晚期默克爾細胞癌(MCC)成人患者。
LEQEMBI是近些年FDA獲批第二款治療阿爾茲海默癥的藥物,它是一種針對聚集的可溶性(原纖維)和不溶性淀粉樣蛋白(Aβ)的IgG1單克隆抗體。今年1月6日FDA通過加速審批途徑批準了LEQEMBI,6月9日藥物咨詢委員會(PCNS)全票通過了衛材的3期Clarity AD臨床試驗數據證實LEQEMBI的臨床益處,傳統批準的PDUFA行動日期為7月6日,該藥物在美國的市場定價為2.65萬美元/年,這要比阿杜卡瑪單抗5.6萬美元/年便宜近3萬美元/年。
Chiesi公司有兩款罕見病藥物上市ELFABRIO和LAMZEDE,均為酶替代療法。ELFABRIO是α-半乳糖苷酶的工程版本,是一種水解溶酶體中性鞘糖脂特異性酶,被轉運到溶酶體后,發揮酶活性減少累積的Gb3,用于治療法布里病。
LAMZEDE是人α-甘露糖苷酶的重組形式,旨在為人體補充天然α-甘露糖苷酶,該酶參與降解富含甘露糖的寡糖,以防止其在體內各種組織內蓄積。
細胞與基因療法加速崛起
今年上半年,CBER批準了10款生物制品,包括兩款基因療法(VYJUVEK和Elevidys),一款同種異體干細胞移植療法(OMISIRGE),一款口服微生物群療法(VOWST),一款重組蛋白藥物(ALTUVIIIO)、一款RSV疫苗(ABRYSVO)。適應癥主要集中在罕見病、抗感染領域。
表3 CBER批準的生物制品
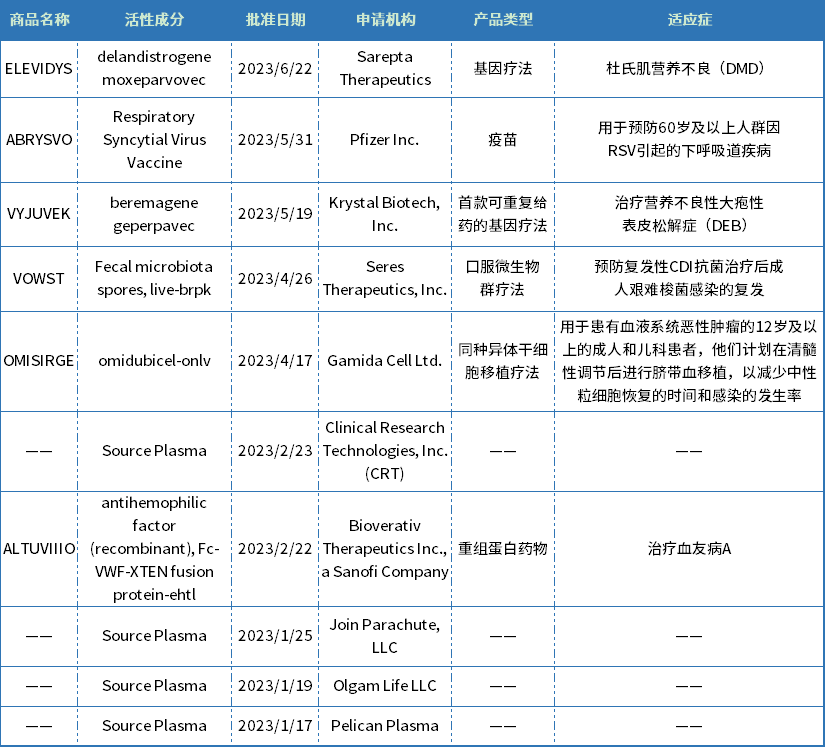
資料來源:美國FDA官網、藥智數據
OMISIRGE是一種煙酰胺修飾的同種異體細胞療法,來源于臍帶血,FDA批準用于患有血液系統惡性腫瘤的12歲及以上的成人和兒童患者,計劃在清髓性調節后進行臍帶血移植,以減少嗜中性粒細胞恢復的時間和感染的發生率。OMISIRGE獲得了FDA的突破性治療指定、優先審評和孤兒藥物指定。
VYJUVEK(beremagene geperpavec)是Krystal Biotech公司研發的一款使用單純皰疹病毒(HSV)載體的基因療法,是首個FDA批準的外用基因療法,也是首款可重復的基因療法,用于治療營養不良性大皰性表皮松解癥(DEB)。DEB是一種罕見病,該病會影響皮膚和黏膜組織,病因由COL7A1基因中一個或多個突變引起,DEB患者缺乏功能性錨定纖維,導致皮膚極度脆弱,輕微摩擦或創傷就會起泡和撕裂。VYJUVEK旨在為患者的皮膚細胞提供兩個COL7A1基因的正常拷貝,生成功能性VII型膠原蛋白(COL7)蛋白。VYJUVEK預計將于2023年第三季度在美國上市,據報道Vyjuvek每瓶的價格為24250美元,每位患者每年需26瓶,年費約為63萬美元,經過政府強制折扣后為48.5萬美元。
Elevidys是由Sarepta Therapeutics和羅氏聯合開發的一款基因療法,也是首個通過加速批準上市的體內基因療法,被批準用于治療杜氏肌營養不良(DMD)。DMD是一種知名的罕見X連鎖退行性神經肌肉疾病,其發病是由于患者體內編碼抗肌萎縮蛋白(dystrophin)的基因發生變異,導致抗肌萎縮蛋白的缺失或功能缺陷,大約每3500-5000例男嬰中就有一例DMD患者。
小結
今年上半年,美國FDA批準的新藥主要集中在抗腫瘤、神經系統、抗感染以及罕見病領域。過去幾年,腫瘤藥一直在CDER批準名單中占主導地位,但是從今年上半年的審批情況來看,抗腫瘤藥物熱度有些許下降,慢病領域熱度上漲。在FDA的政策鼓勵下,藥企對罕見病治療藥物的研發熱情依然高漲,是近年來新藥產出最主要的領域之一。
另外,過去20年投入巨大的阿爾茨海默病領域終于迎來了突破,衛材的LEQEMBI獲加速批準上市,禮來的donanemab 3期臨床試驗成功。
下半年FDA又會批準哪些藥物呢,我們拭目以待!
參考資料
1. 一波三折,這種百年怪病的首款療法是如何誕生的?
2. EPKINLY™ (epcoritamab-bysp) Approved by U.S. FDA as the First and Only Bispecific Antibody to Treat Adult Patients with Relapsed or Refractory Diffuse Large B-Cell Lymphoma (DLBCL).
3. FDA Advisory Committee Votes Unanimously to Confirm the Clinical Benefit of LEQEMBI® (lecanemab-irmb) for the Treatment of Alzheimer’s Disease.
4. 各企業官網、FDA官網以及藥智數據等公開信息。
聲明:本文系藥智網轉載內容,圖片、文字版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請在本平臺留言,我們將在第一時間處理。
上一頁:
下一頁:



